
 | |
|
Слаботочка Книги 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 [86] 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 где С - концентрация (-го компонента, % объемные; р, - плотность 1-го компоненш: Pi-y - плотность смеси. Из (8.24) - (8.26) видно, чтопрн измерении плотности газов следует искл)очи1ь влияние колебаний температуры и давления. Если измерение плотности используе>тся как метод определения состава смеси из двух ком1и> нентов (бинарная смесь), то плотности комио-нентов должны сушественно различаться. С учетом дтого на рис. 8.37 приведена схема поплавкового плотномера, применяемого для измерения плотности газов. В приборе в камере 13. через которую проходит исследуемый газ, производится непрерывное взвешивание стеклянного гнара 5, заполненного азотом. Так как обьем шара v и масса т вьг-lecHCHHoro И.м газа в плотномере постоянны, то масса стеклянного шара 5 однозначно определяет плотность газа [см. (8.22)]. Так как колебания темперагуры и давления газа одинаково влияют на массу стеклянного шара 5 и противовес 10, то тем самым исключается их влияние на результаты измерения. Влагомеры. Содержание водяных паров в газах выражается абсолютной или относительной влажностью. Абсолютная в.шжиость указывает содержание водяных паров в единицах объема влажного или сухого газа при О "С и 760 м.м рт. ст. Взаимный пересчет абсолютной влажности, отнесенной к сухому и влажному газу, производится по формуле а = ао/(1 +с(о/804), (8.27) где а - содержание водяных паров во влажном газе, - содсржатше водяных паров в сухом газе, г/м. Относительная влажность показывает отношение содержание водяных пар(ж в 1 м, к максимально возможному содержа- нию их (в состоянии насьшсения) при той же температуре. OтнocитeJьнaя влажность выражается в относительных единицах или в процентах и соответственно рассчитывается по формулам Ф = Змакс; Ф = ЮО/яас, (8.28( где а - абсолютная влажность, г/м"*; У-якс - абсолютная влажность воздуха в состоянии насыщения при данной температуре, г/м. Иногда относи т едьная влажтюсть, %, выражается соотношением Ф = /п.р,, iOO/Рнас, (8.29) тде Р„ир11 - парпиа-тьное давление (упрут ость) водяных паров, находящихся в газе; Р„у. -максима.1тьно возможное партша-чьнос давление водяных паров в тазе при насыщенном состоянии. Определение влажности по отношетшю napnnajTbHbix давлений является прибли-зитсльтшш, ттот ому что водяные ттарьт не точтю подчиняются уравнению идеального газа. В производственных условиях влажность газов обычно выражается темнерат урой точки росы и представляет собой температуру, при которой газ насыщен парами воды. Если охла,тить газ ниже точки росы, избь[[ок водяного пара начнет конденсироваться. Перевод влажттости, выраженной температурой точки росы, но влажность, выраженную в .мг/м, ттриведен в табл. 8.5. В настоящее время существует несколько методов и тмерения влажности т азов и воз,туха. Наибольшее практическое применение нанити следующие методы: психрометрический, точки росы, ку.тонометрический. Психрометрический метод остюван на измерении т емттературы двумя т ермомет-рами - «сухим» (обыкновенным) и «мокрым» (смоченным водой). По разности температур с помощью таблиц или номограмм определяется относительная влажность. В промыш- Т1 ТО 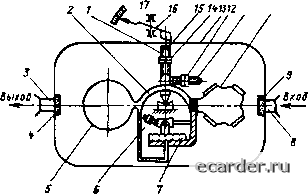 Рнс. 8.37. Схема плотномера газов: / п М - устройства рег\лнровкт1 чувствительности; 2 - коромт.тсло; Зи8 - входной н выходной ттттуцера. 4 и 9 - пористые стек.тянные фильтры; 5 - тонкостетптый полый стеклянный тнар. б и 7 - груз и >тембран-ттая коробка, компеттспруютнне изменение лавления » температуры !аза, 10- полый открыЫЙ стскляттый TTiap (противовес); и /2 - устройства лля балаттснроики коромысла; /3 - измерительная камера; !5 - постоянный магнит; 16 - стре.т-ка Тфибора; 17 ~- тикала прибора 8.8. Средства измерения плотности и влажности газов Таблица 8.5 Перевил в.1ажнос[и, выраженной температурой. С, точки росы, в Mi/\i
ленности этот метод мало применим вследствие большой погрешнос ги о i эа1 рязне-иия устройства, смачиваюшего влажный термометр. Психрометры обладают большой ннерпио/шостью, а также не Mosyr использоваться для измерения влажности i азов при огрицагельных температурах Метод точю! росы основан на определении температуры поверхнос ги твердо! о тела (ме1аллическото зеркала, кварца и т. п.), при которой на нем конденсируется влага из окружаюшеи среды Начало конденсации влаги на поверхнос i и тела определяется различными мето гам и Метод точки росы дозволяет измерять влажность газа при июбых давлениях этого laia При неизменном давлении температура точки росы не laBHCHT от температуры исследуемого газа, бJ!aloдapя чему н.меется возможное (ь установки да1чика вне исследуемой срелы и подвода к нему контролируемого газа по трубопроводу Ку шнометрнческий метод основан на поглощении влз! и из анализируемой среды н ее Электролизе. Значение тока электролиза является мерой концентрации влаги. Чувсрви-тел!ьный элемент кулопометрического датчика влажности показан на рис. 8.38. 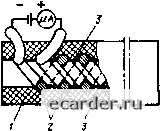 Рис. 8.38. Чувствитс-тьный элемент ;1атчиков кулонометрических влагомеров Ч увствительный элемент имеет пласт массовый корпус /, во внутреннем канале которого размещены два металлических электрода 2 в виде геликоидальных несоприкасающихся спиралей Между электродами нанесена пленка 3, частично i идратрован-ная пятиокисью фосфора, обладающая очень хорогпей высушивающей способностью. Через чувстви1ельный элемент в направлении, указанно.м стрелками, непрерывно подается анализируемый газ. Расход газа поддерживается постоянным при помощи регулирующих устройств. Геометрические размеры элемента и расход газа подбирают глкмм образом, чтобы влага целиком извлекатась из таза. Поглощенная вла1 а соединяется с веществом пленки и образует концентрированный раствор фосфорной кислоты с электропроводностью, ттропорциопальной количеству поглощенной Bjrai и К электродам присоединен источник т!Осгоянного тока. Одновременно с погло1т!ением в.наги в толше вещества пленки ведется разложение ее электролизом. Образуют![иеся 1три этом кислород и водород уносятся ттоюком анализируемого газа. Количества поглощенной и разложенной в единицу времени воды при установившемся режиме равны, и благодаря этому протекающий в цени ток пропорционален кон-цеггтрации влаги в ана-тизируемом газе. В качестве вторичных приборов (плотномеров и влаюмерой), как правило, используются стандартные злектронные потенциометры и мосты. Методы их наладки были рассмотрены выше. Раздел 9 НАЛАДКА СРЕДСТВ ИЗМЕРЕНИЯ СОСТАВА И КАЧЕСТВА РАСТВОРОВ ВЕЩЕСТВА 9.1. АКТИВНОСТЬ ВОДОРОДНЫХ ИОНОВ КАК МЕРА ЩЕЛОЧНОСТИ И КИСЛОТНОСТИ водных РАСТВОРОВ Одним из факторов, характеризующих физико-хи.мические, биохимические и химические процессы в различных отраслях промышленности, является активность ионов водорода, натрия, хро.ма и других веществ в растворах. При измерении состава и качества вещества наиболее широко используется свойство ионов водорода в водных растворах вещества, опредетяющих меру кислотности и [цедочиости растворов. 9.1.1 НЕКОТОРЫЕ СВЕДЕНИЯ ИЗ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Чистая вода очень слабо диссоциирует на катионы водорода И и анноны гидроокиси ОН" по схеме HiOi Н + ОН". (9.1) Стрелки, направленные в обе стороны, указывают на то, что наряду с диссоциацией молекул на ионы одновременно и;ет процесс соединения (рекомбинации) ионов в молекулу воды В результате одновременно идущих процессов диссоциации молекул и рекомбинации ионов устанавливается динамическое равновесие, при котором за равные промежутки времени число распавшихся молекул оказывается равным числу вновь образующихся Мерой количества вещества является грамм-ион, з е. то количество ионов, масса которых численно равна атомной массе Произведение концентраций ионов [Н"], г ион/л, и [ОН"], г ион/л, образующихся в процессе диссоциации воды, называется ионным произведением воды и записывается в виде Кн,о=[Н] [ОН-] = const (9,2) Коэффициент КнгО зависит от температуры. Однако в интервале температур 20 - 25 °С значение коэффициента КнгО можно принять равным IQ-*. Постоянство значения Кно интервале температур 20 -25°С позволяет для любого водного раствора найти концентрацию ионов [ОН"] при известной концентрации [Н"] и наоборот, так как [ОН"3= io-V[H]; [Н*] = 10-V[OH ] В чистой воде и любом нейтральном растворе концентрации [Н"] и [ОН"] одинаковы и равны 10" г ион/л. Есливводном растворе[Н*] > [ОН~] > > 10~ г ион/л, то раствор имеет кислую реакцию, если [Н*] < [ОН"] < 10" г ион/л, то раствор имеет щелочную реакцию. Молекулы кислот, солей и щелочей в водных растворах также обладают свойством диссоциировать на положительные и отрицательные ионы. Так, молекулы соляной кислоты в водном растворе диссоциируют на положительные (катионы) Н" и отрицательные ионы (анионы) КИСЛОТНО! о остатка С1". что можно записать так: НС) Н + СГ (9.3) Таким образом, в водных растворах кислот, солей и щелочей кроме катионов [Н"] и анионов [ОН"], полученных при диссоинацни воды, имеется большое количество положительных и отрицательных ионов, полученных при диссоциации растворенного вещества. В результате электростатического взаимодействия ионов часть их соединяется в ионные пары и оии становятся неактивными, что приводит к изменению активной концентрации ионов [Н"] и [ОН"]. Произведение [Н"] и [ОН"] для данной температуры остается величиной постоянной. В растворах, содержащих большое количество различных ионов, активная концентрация ионов водорода может значительно отличаться от их общей концентрации и определяется выражением ан = [Н*]/. где ссн - активность ионов водорода, г ион/л; [НЗ ~ концентрация ионов водорода, г ион/л;/-коэффициент активности. Мера активности нонов водорода. В растворах, применяемых в промыныениости, активность выражается дробньтми числами. В связи с этим для удобства было предложено характеризовать активную кислотность или щелочность растворов при помощи отрицательного логарифма активности ионов водорода (ан). Эта величина обозначается 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 [86] 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 |