
 | |
|
Слаботочка Книги 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 [87] 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 символом рН: рН= -Igan; ан = 10"" или рН = 1§(1/ан). (9.4) Для нейтральных растворов при с(ц = = 10" г-ион/л значение рН = 7. Кислые растворы имеют рН<7, а щелочные рН > 7. Весь диапазон изменения значения рН растворов от самого кислого до самого щелочного характеризуется рядом чисел от 0 до 14. В этом диапазоне изменению рН раствора на единицу соответствует изменение активной концентрации ионов водорода в 10 раз, например раствор с рН - 3 в 10 раз активнее, чем раствор с рН = 4. Таким образом, при измерении рН измеряют не концентрацию кислоты илн щелочи в растворе, а активность ионов водорода. Этим обстоятельством, в частности, объясняется значительное уменьшение значения рН щелочных растворов с увеличением температуры, хотя вода по-прежиему остается нейтральной, а количество щелочи остается неизменным. Конц»1трация растворсш. В рН-метрии используются химические растворы, в том числе и буферные, которые могут имегь различное вьфажение концентрации. Буферные растворы обладают стабильностью числа рН при разбавлении их водой, а также дроблении некоторо! о количества свободной кислоты или щелочи. Концентрацией раствора называется количество вещества в единице объема или ияссе растворителя. Процентна.ч концентрация - количество граммов растворенного вещества в растворе. Молярная концентрация {.\имярность) С„ - количество грамм-молекул растворенного вещества в одном литре раствора (т-мол/л). Размерность конпентрации молярных растворов обозначается буквой М. rpa.MM-.\w.ieKy.ta - масса вещества в граммах, численно равная ею молекулярной массе. Например, 2М раствор NaC! получается прн растворении 116 г NaCl в 1 л воды (молекулярная масса равна 58). Нор.мальная концентрация (нормальность) - количество молей (грамм-эквивалентов) растворенного вещества в 1 л раствора (г-экв/л нли мг-экв/мл). Растворы, концентрация которых выражена таким способом, называются нормальными. Размерность концентрации нормальных растворов обозначается буквой н. (с точкой), а значение концентрации определяет нормальность раствора. Например, если в 1 л раствора содержится 1 г-экв вещества, т о его концентрация равна 1 н. Такой раствор часто называется однонорма.гьным. Расгвор с концентрацией 0,5 н. называется полунор .чальным. Нормальность и молярность растворов одноосновных кислот н ще-ючей совпадают, гак как грамм-эквиваленты этих веществ равны их грамм-молекулам, Грамм-эквивалент соответствует массе эквива-тента химического, под которой понимается безразмерная величина, равная отно-щеиию массы элемента к массе соединяющегося с ним водорода или к массе вещества, замещающего водород в соединениях. Например, 0,1 н. раствор НС1 получается при растворении 3,6 г НО в воде (молекулярная масса равна 36, значит, грамм-эквивалент = грамм-молекуле = 36 г), объем которого доводится до 1 л. Однонормальный (1 н.) раствор HjS04 получается при растворении 49 г H2SO4 в воде (молекулярная масса равна 98, грамм-эквивалент равен 98/2 == 49), обьем которою доводится до 1 л. 9.1.2. МЕТОДЫ ИЗМЕРЕНИЯ рН Существует несколько методов измерения рН, основными из которых являготся колориметрические и электрометрические. Колориметрические методы основаны на свойствах некоторых веществ, называемых индикаторами, изменять свой цвет в завис1Шости от значения рН раствора. Например, при помощи бумажных индикаторов можно легко и быстро определить тгримерное значение рН. Электрометрические методы измерения основаны на электрическом ЭJfeктpoднoм эффекте водородных ионов. Они дают высокую точность измерения рН и позволяют получить непрерывность измерений. Электрометрических методов два: кондуктометрический и i а,тьванометрический, Кондук10метрический метод, основанный на определении электропроводности раствора сильных кислот и щелочей с последующим расчетом значения рН, применяется довольно редко. Гальванометрический метод основан на измерении разности потенциалов электродных систем избирательного действия, ЭДС которых зависит от активности концентрации ионов водорода в растворе. В Практике промышленного измерения значения рН по гальванометрическому методу наиболгьгиее распространение получили электродные системы, состоящие из стеклянного измерительно! о электрода и хлор- 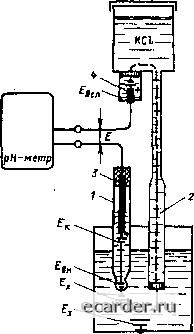 Рис. 9.1. Схема работы электродной системы: / - стеклянный электрод 2 - 1.1ек1ролитический ключ, i - контактный э,гектрол, 4-bcnomoia-тельный электрод сравнения сереоряною или каломельного электрода сравнения. Гальваночетрнческий меюд ишерения рН основан на измерении электродвижущей силы 1 альваническо! о элемента, Этот метод измерения получил наибольшее применение в промышленности. Гальванический элемент представляет собой систему проводников первого рода {элек 1 роды) и проводников второго рода (растворы электролитов), находящихся в контакте В качестве электролита 1,ри измерении рН используется анализируемый раствор. Элек 1 ро [вижущая сила {ЭДС) i альва-ннческою элемента складывается из 01дель-ных ЭДС, возникающих в месте контакта проводников riepBoi о и второго родов (электрод-раствор j тектролита) и проводников второю рода (растворы электролитов). Последняя носит название диффузионного потенциала. При погружении в анализируемый раствор измерительно! о злектрода на его наружной поверхности появляется потенциал £j, который является мерой активности ионов водорода. Измерить значения непосредственно нельзя, так как в этом случае между проводником прибора и раствором возникает ЭДС. Поэтому для снятия потенциала Е применяют еще один электрод, так называемый вспомогательный (электрод сравнения). Схема работы электродной системы показана на рис. 9.1. Электродвижущая сияа системы Е - Е + £нн + BLN + (9.5) где - потенциал дополнительного (контактного) электрода в сташ1артном растворе, находящемся внутри шарика; £вгг ~ [тотенниа-т внутренней поверхности стекла в стандартном растворе, £всп ~ потенциал дополнительного вывода вспомогательного электрода в растворе, находящемся внутри вспомогательного электрода; £., - потентщал наружной поверхнзэст и с т ckjt янного электрода в ана-тизируемом растворе При зтом значение диффузиогшого потенциата между анализируемым раствором и раствором внутри bchomoi ательного электрода должно быть достаточно малым (допустимым), чтобы не искажать точность электродной системы при измерении рН. Через пористую перегородку на конце всттомот ательного электрода 4 осуществляется электролитический контакт дополните:ть-нот о вывода вспомогательного электрода с анатизируемым раствором. Этот вич контакта часто называют э гектролитическим ключом Электролитический ключ позволяет тю-лучить неполяризуюшийся элек т род, хотя на границе раздела двух сред (как указывалось выше) возникает диффузионный потентщал, зависяцши от ряда факторов, учесть которые практически очень трудно. Пористой nepei ородкой электролитического ключа может служить асбестовое волокно, пористая керамика, шлиф (тцель между притертыми стеклянными поверхностями), пористый эбонит и т п. Все эти MarepnajTbi создают сравнительно неболь-тттие диффузионные нотентщалы. Кроме того, ттерет ородка должна позволять раствору вспомогательного электрода непрерывно с определенной скоростью вытекать, что обеспечивает постоянство и неизменность физическото состояния границы раздела, а CJ!eдoвaтeлыю. в какой-то степени определяет постоянство диффузионного потенциала. Обрат ное направление потока через пористую ттерет ородку недопустимо, так как при этом искажается результат измерения и можег произойти «отравление» дополнительного вывода вспомот ательного электрода Таким образом, считая с достаточной степенью точности значения £к. Ев,, и Ef. постоянными, видим прямую связь между £ и t\, т. е. ЭДС эдектродной сис1емы опре-ледяет активное! h ионов водорода, а значит, и значения рН. 9.2. ПРОМЫШЛЕННЫЕ СИСГЕМЫ ИЗМЕРЕНИЯ рН Система измерения рН. как и любая измерительная система, представляет собой соио-KyjjHocTb средств измерений (измерительно! о и BCHOMoi ательного электродов, преобразователей и измери гедьных приборов) и вспо-мотательных устройств, соединенных между собой каналами связи и предназначен ныл для выработки сигна.1а измерительной информации в форме, удобной автоматической обработки, передачи и (или) использования в ав соматических системах управ-ления. В технической литературе час!о применяют термин «рН-метр», подразумевая под КИМ систему измерения рН. Промышленные рН-мСфы применяются в качестве рабочих средств измерений 9.2.1. СТЕКЛЯННЫЕ ЭЛЕКТРОДЫ Нормативно-технические документы Госс1андарта СССР дают определение терминов, относяшихся к рН-метрии, Стеклянный электрод - электрод, предназначенный для преобразования значения активности ионов водорода (значения рН) в значение электрод вижу шей силы. Электрод вспо\1огательный - электрод, предназначенный для создания опорного потенциала при работе в паре со стеклянным или другим индикатором при «отенцномет-рических измерениях. Чувствительный элемент длн uivtepenuH рН - устройство, состояп1ее из стеклянното и вспомогательного электродов, объединенных арматурой, в котором под воздействием анали1ируемой среды возникает ЭДС, пропорциональная активности водородных ионов. В качестве измерительных sjickt родов рН применяют стеклянные водородные и сурьмяные атектроды. Водородный электрод получают при насытценнн платиновой черни чистым водородом. При из.мерениях часть электрода, насыщенная водородом, должна непрерывно омываться потоком водорода извне. Ecjm соблюдать осюрожносгь при работе и применять чистый водород, то в растворах, не содержащих ветттеств, легко адсорбируемых платиной или окисляющих водород, можно получить очень точные значения рН. Промышленная экст1луатация этих электродов вызывает определенные трудности. Сурьмяный электрод применим для измерений в суспензиях и коллоидных системах, в конттентрированных рас i ворах солей металлов с более отрицательным стандартным пoтeнциaJЮM, чем у сурьмы (тгрисутст-вие солей Bi, Pb. Sn и других искажает ре)уль-татьт). Окислители-восстановители искажают результаты измерений, и в их присутствии оттределение рН сурьмянам электродом тена-дсжно. Благодаря ттростоте устройства и механической прочности сурьмяный )леьгрод иногда находит ттрименение при прои шод-ствентгых измерениях, хотя точность измерения не Bcei да достаточна. Наиболее njjfpOKoe распространение в промытпленности получил стеклящтьш этект-род. с Сто ттомощью можно производить измерения в растворах, содсржа1гщх сильные окнслнтсчи и восстанов1!Теди, г. е. там. где нево 1МОЖНО использоват ь водородный и дру-т ие элек i роды. Для изго i овления стеклянных электродов ишользуюг специальный вид стекла - так называемое электродное стекло. Свойства jj[eктpoднoтo стекла были определены экспе-pHMCHTaJTbHO в начале XX в., а в дальнейшем была разработана теория стеклянното электрода. Согласно теории Б. П. Никольского образование потенцна.1а электродного стекла обусловлено процессами ионного обмена между cTCKjfoM и раствором. Структура стекла рассматривав 1ся как неподвижный анионный силикатный скелет, внутри которого могут двигаться только катионы щелочные, катионы натрия и лития расттолагаются в узлах силикатной рерпетки. При соприкосновении с раствором эти ионы вытесняю (СЯ более подвижными и имею-щими менттпий радиус иоиами водорода, которые и придают сгеклу свойства волород-нот о электрода. Пропесс ионного обмена продотжается до наступления сосгояния равновесия, которое зависит от активностей ионов щелочного металла и водорода в растворе, а также от прочное! и их связи в стекле и растворе Необходимо иметь в виду, что в стеклянных ЗJтeктpOдax наблюдаются неодинаковые гготенциалы внешней и внутренней поверхностей по отношению к одному и тому же раствору. Эта разность потенциалов называется тготснциалом асимметрии. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 [87] 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 |