
 | |
|
Слаботочка Книги 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 [97] 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 9.5. НалаОка системы измерения рН Юстировка при необходимости произво-лится несколько раз до полною совпадения показаний преобразователя со значениями рН буферных растворов па начальных и конечных отметках 1икалы. Если температура анализируемою раст-йора реально изменяется в широком диапазоне (15-100 или О -35"С), то необходимо провести дoпoлниIeJ[Ьнyю проверку по одному нагретому и охлажденному буферным растворам. В зтом случае обязательно применение электродов со значением рН„, близким к рН анализируемою раствора. Юстировка показаний преобразователя по нагретому и охлажденному буферным paci ворам тфоизводится переменным резистором рНн точно (при необходимости и рН„ грубо). После юстировки нанги переменных резисторов CJтeдyeт затянуть. При отсутсгвии стандартных буферных растворов для требуемого диаттазона измерений необходимо, чтобы химическая лаборатория приготовила козггрольньте растворы со значениями рН, близкими к значениям начала н конца шкалы требуемот о диапазона. Значения рН контрольных расзворов оттределяют лабораторным рН-метром. nocjTc выттолнения всех указанных операций система измерения рН считается подготовленной к включению на рабочих средах. Включение и контроль работоспособности системы. Перед включением системы измерения рН на рабочих средах следует убедиться, что темттература в месте установки чувствительного элемента с-оответствует требуемой, а давление ана-тизируемой среды находится в рабочем диапазоне. Кроме того, значение рН анализируемой среды, определенное с помошью лабораторного рН-метра, дoJтжнo находиться в диапазоне измерения промышленною рН-метра, Если давлетше в месте установки меняется, то Следует подключить peгyJTятop РДС-1, установив его на кронштейнах чувствительного темен га (рис. 9 20). Практика проведения пускона.1адочныл работ по системам измерения рН показывает, что в начальный период включения эти системы требуют шшельного и четкого обслуживания. В зависимости от свойств анализируемой среды должен быть подобран оптимальный расход КО через электролитический ключ вьшосного вспомот а тельного электрода, В период начального включения чаше обычного возникает разрыв зтек т ри ческой цепн электролитического ключа за счет выле- К бачку ВспопоЛ. гательного Гг электрода. РЛС-7
подВвд вспомо-еа.тельноеа догвления к Подвод контролируе-I mow среды Рис. 9.20. Установка регулятора РДС-1 на чувствите тьном злемен1е рН ления пузырьков воздуха, образующихся при сливании раствора хлористого калия в бачок вьпюсного электрода, hjth адсорбции раст вора «сухим» шлангом электролитического ключа. Для устранения этого явJтeния в бачок с КС! помешают шайбу из пробки, а раствор КС1 наливают в бачок через воронку непосредственно на шайбу, способствуя спокойному растеканию раствора КО. Иногда для гарантии целостности электрической цепи KJTm4a вдоль шланга от бачка до наконечника пропускают асбестовый шнур. С этой же целью в непроточных электродах ЭВП-08 между внутренней стенкой электрода и мембраной тюмещаю: хлопчатобумажную нить. При оттенке работоспособности рН-метров на различных усшновках следует тюмнить, что Отечественные стандартные чувствительные 3jTeMeHTbi не предназначены для измерения числа рН водных растворов, содержащих фтористоводородную кислоту hjth ее соли и вещества, образующие осадки или пленки на поверхности стеклянных электродов. Важным элементом контроля правильности показаний рН-метра является возможность отбора пробы в месте монтажа для лабораторно! о рН-метра. Следует заметить, что кроме стандартных чувствительных элементов некоторые организации выпускают опытные образцы чувствительных элементов применительно к конкретным процессам. Например, при производстве аммиачной селитры нашли применение устройства УРП-2 н УРП-И. Устройство разбавления плава УРП-2 предназначено для непрерывной подготовки анализируемой пробы путем плава аммиачной селитры в воле (конденсате) до определенной концентрации (плотности) с целью последующего измерения значения рН раствора Плав имеет температуру 140-ISOC, а его водный раствор -25-г-ь80°С. На разбавление плава должна подаваться химически очишенная вода с постоянным числом рн и со стабилизированным давлением. Устройство УРП-И является упрощенной модернизированной конструкцией УРП-2. Погрешность измерения рН будет наименьшей при использовании стеклянного электрода со значением координаты рН изопотенциальной точки, ближайшей к контролируемому значению рН, согласно технологическому регламенту. Практика проведения наладочных работ подтверждает значительное влияние на работу системы измерения рН электромв! нитных нолей. Так, искажения показаний наблюдались при работе сварочных аппаратов на расстоянии 4 - 6 м от мест установки чувствительных Элементов и измерительных приборов Повышенные электромз! нигные помехи могут быть также следствием отсутствия экрана на части проводника измерительною электрода, плохого заземления корпуса преобразователя и экранирующей оболочки кабеля, наличия поблизости от места установки преобразователя каких-либо электрических аппаратов переменного тока. Кроме того, необходимо постоянно помнить о значительном входном сопротивлении преобразователя и следить за состоянием герметичности кабельных вводов в распределительные коробки и коробки зажимов преобразователей, за плотностью закрытия крышек- При работе системы измерения рН возможны случаи замены стеклянных электродов. При этом следует учитывать, что зна- чение потенциалов асимметрии у разных электродов одного н того же типа и даже одной поставляемой партии могут различаться. Поэтому после замены электрода необходимо проверить систему по контрольным (или буферным) растворам. 9.6. КОНДУКТОМЕТРИЧЕСКИЕ КОНЦЕНТР АТОМЕРЫ Кондуктометрические концентратомеры основаны на измерении удельной электрической проводимости растворов. Электрическая проводимость водных растворов кислот, солей и щелочей oбycJЮвливaeтcя на.1ичием в них днссоцннрованных молекул растворенного вещества и зависит от его концентрации, степени диссоциацни, химической природы вещества и температуры раствора. Сопротивление жидкости электрическому току определяется так же, как сопротивление проводников: R = pl/S, (9.12) где К - сопротивление. Ом; / - длина жидкого проводника, см; S - сечение жидкого проводника, см; р - удельное электрическое сопротивление. Ом см. Величина ст, обратная удельному электрическому сопротивлению р, называется удельной электрической проводимостью; ст = 1/р. Единицей удельной электрической проводимости в системе СИ принят снменс на метр (См/м) или снменс на сантиметр (См/см). С учетом того, что 1/R = G, где G-проводимость, удельную электрическую проводимость можно выразить уравнением ст = GI/S. (9.13) Для MHOI их неорганических веществ удельная электрическая проводимость ст является нелинейной функцией их концентрации. Обычно при повышении концентраЕГИи электролита в воде удельная электрическая проводимость сначала возрастает, что можно объяснить увеличением количества ионов, а затем начинает падать в связи с тем, что при дальнейшем росте концентрации сокращаются расстояния между ионами, возрастают силы электростатического взаимодействия между ними и снижается степень диссоциации молекул. i9.6. Кондуктометрические концентратомеры 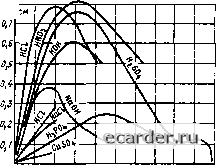 о 10 го 30 0 50 so то во €,"10 Рис. 9.21. Зависимость удельной электрической проводимости а некоторых растворов от концентрации при 2Q°C На рис. 9.21 представлена зависимость удельной электрической проводимости ст некоторых растворов от нх коицентрации С при t = 20 °С. Каждое вещество, присутствующее в растворе, влияет на его общую электрическую проводамость в соответствии со Значением своей собственной проводимости. У слабо концентрированных растворов электрические проводимости отдельных веществ можно суммировать. Таким образом, приборы, основанные на измерении электрической проводимое ги растворов, показывают полную проводимость, созданную различными содержащимися в растворе ионами. Концентрацию одного вещества в растворе можно определить только в том случае, если электрическая проводимость остальных веществ значительно ниже или их концентрация остается постоянной. Для слабых растворов зависимость удельной электрической проводимости электролитов от температуры выражается формулой о, = (7,8 [1 + a„(t - ?о) + РЛ - h)\ (9.14) где ст, - удельная электрическая проводимость электролита прн температуре I; CTih - удельная электрическая проводимость электролита при температуре 18 °С; ot„ и 3„- температурные коэффициенты. Температурный коэффициент может быть рассчитан по эмпирическому соотношению За = 0,163 (ot„-0,0174). (9.15) Для слабых растворов солей температурный ко,эффициент а„ в среднем равен 0,024 1/1 рад и колеблется от 0,021 до 0,026 1/град. Для щелочей я„ я= 0,019 1/град, для слабых растворов кнаютао я= 0,017 1/град. Таким образом, электрическая проводимость слабых растворов увеличивается на 1,5-2,5% при нагревании их на 1 °С. Для средних н сильных растворов температурный коэффициент проводимости еще выше. Поэтому во всех измерительных приборах предусматривается либо автоматическая комненсання температурной погрешности, либо стабилизация температуры исследуемого раствора в процессе измерения. Промышленные кондуктометрические концентратомеры, основанные на измерении удельной электрической проводимости жидких смесей, делятся на два основных вида: контактные, у которых электроды непосредственно соприкасаются с испытуемой средой, н бесконтактные, у которых чувствительный элемент изолирован от испытуемой среды слоем стойко! о к данной среде материала. Контактные кондукгомеры. В контактных кондуктомерах нзмеренне концентрации какого-либо вещества в растворе сводится к измерению электрической проводимости электродной ячейки, заполиенной этим раствором. Сопротивление электродной ячейки переменному току можно измерить, используя закон Ома для участка цепн: Z = С/7, [ де и - падение напряжения иа участке жидкостной цепи. В; / - ток, протекающий в цепи, А. При измерении сопротивления электролита ПОСТОЯ1ШОМУ току указанным методом возникает поляризация электродов, поэтому результаты измерения получаются неверными. Для расчета удельной электрической проводимости ст по (9.13) необходимо знать площадь электродов S и расстояние между ними /. Практически значения этих величин трудно определить с достаточной точностью даже прн сравнительно простой конструкции .электродов. Поэтому значение S = Ся, где Ся - константа электродной ячейки, определяется опытным путем и при измерениях должно оставаться постоянным. На рис. 9.22 показаны измерительные схемы автоматических контактных кондуктомеров. В схеме на рис. 9.22, а R, и Ri- постоянные манганиновые резисторы; Rj - переменный резистор для температурной компенсации непостоянства параметров ячейки прн изменениях температуры; Rp - регулируемый резистор; R и C,t - сопротив- 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 [97] 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 |