
 | |
|
Слаботочка Книги 1 [2] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 перемагничивание стержня и соответствующее периодическое закручивание нити с зеркальцем а. Когда частота переменного поля совпадет с собственной частотой колебаний закручивающейся системы, то амплитуда колебаний зеркальца вследствие резонанса сильно увеличится и достигнет значений, доступных наблюдению. Подобные опыты впервые были осуществлены Эйнштейном и де Гаазом. Магнетомеханические свойства атомов проявляются также в другом явлении, замеченном Барнетом. Если стержень подвергнуть быстрому вращению вокруг его оси, то даже при отсутствии какого-либо внешнего поля возникнет намагничивание в направлении оси вращения. Последний эффект аналогичен следующему механическому явлению. Если укрепить на подставке гироскоп (которому в нашем случае соответствуют атомы тела) и привести ее (кристаллический скелет твердого тела) во вращение, то ось вращения гироскопа будет стремиться ориентироваться в направлении оси вращения подставки (чему в нашем случае соответствует направление намагничения тела). Явление, наблюденное Барнетом, имеет, таким образом, ту же природу, что и эффект Эйнштейна и де Гааза. Как первый, так и второй эффекты позволили определить численные значения гиромагнитного отношения g для различных веществ. При этом для ряда ферромагнитных металлов и сплавов было найдено, что g вдвое больше, чем это следовало бы, если бы элементарными магнитиками являлись орбитальные магнитные моменты. Данные, полученные из магнетомеханических опытов, свидетельствуют о том, что в намагничивании ферромагнетиков орбитальные магнитные моменты практически не принимают участия и что внешнее поле влияет главным образом на ориентацию спиновых магнитных моментов. Таким образом, магнетомеханические опыты дают непосредственные экспериментальные доказательства того, что элементарными носителями магнетизма в ферромагнетиках являются спиновые магнитные моменты электронов. Рассмотрим теперь строение атомов ферромагнитных веществ (в изолированном состоянии). Как известно, электроны в атомах занимают различные энергетические уровни, определяемые квантовыми числами. Для наглядности часто ноль- зуются Представлением о том, что в атоме имеются более или менее резко разграниченные оболочки, содержащие определенное количество электронов, обращающихся вокруг ядра. Некоторые из оболочек в свою очередь подразделяются на слои или подоболочки. В теории атома принято различные оболочки и подоболочки обозначать индексами Is, 2s, 2р, 3s, 3/7, Ъй, 4s и т. д. При этом цифра указывает номер оболочки, а буквой обозначается подоболочка. Электроны в атоме всегда стремятся занять места в оболочках и под-оболочках, лежащих ближе к ядру, как более выгодных в энергетическом отношении. Поэтому при образовании электронных оболочек атома, как правило, сначала заполняются оболочки и подоболочки, расположенные ближе к ядру, а затем уже более удаленные. Однако есть атомы, у которых эта последовательность заполнения мест электронами нарушается. Именно, максимальное число электронов в каждой оболочке не всегда достигается к моменту начала образования следующей оболочки. Тогда в атоме появляются так называемые незаполненные оболочки и подоболочки. Элементы, состоящие из таких атомов, называются переходными; к ним принадлежат, в частности, и элементы, обладающие ферромагнитными свойствами (Fe, Со, N1, Gd). Посмотрим теперь, каким образом устроен атом ферромагнитного металла, например железа, и какими магнитными свойствами он обладает, будучи в изолированном состоянии, а также находясь в окружении других атомов железа. Атом железа содержит 26 электронов, которые можно подразделить на четыре оболочки. Первая, самая внутренняя оболочка содержит два электрона (ls-электроны), вторая - восемь (2s- и 2/7-электроны), третья -14 (3s-, Зр-, Зй-электроны) и последняя- два (45-электроны). При этом вторая оболочка состоит из двух (s и р), а третья - из трех (s, р к d) подоболочек (рис. 2). Третья и четвертая оболочки атома не достроены: при нормальной достройке в первой из них должно было быть 18 электронов, а во второй - 32. Недостающие четыре электрона в третьей оболочке приходятся на подоболочку dd. В электронных оболочках некоторые электроны имеют спины, ориентированные в одном направлении, другие-в прямо противоположном; эти направления спинов для последующего удобно обозначить положительными и отрицательными знаками. Рис. 2 показывает, сколько электронов с положительными и отрицательными спинами имеется в каждой оболочке атома железа; мы видим, что первая и вторая оболочки содержат одинаковое число электронов с положительными и отрицательными спинами. Магнитные спиновые моменты электронов в каждой из этих оболочек взаимно компенсируют друг друга так, что последние в магнитном отношении являются нейтральными. 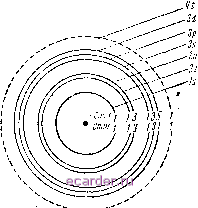 Рис. 2. Электронные оболочки и подобо-лочки в атоме железа. Электроны незаполненной подоболочки 3d являются элементарными магнитиками железа. В третьей оболочке первые две подоболочки 3s и Зр, как вид(!о из рис. 2, нейтральны в магнитном отношении, тогда как в подоболочке Зй? имеется пять электронов с положительным спином и один с отрицательным. Таким образом, четыре электронных спина из подоболочки 3d остаются нескомпенсированными, а следовательно, весь атом в целом имеет определенный результирующий магнитный момент. Наружные - валентные -электроны атома железа, находящиеся в оболочке 4.?, в общем случае также могут быть пескомпенсированы. Опыты установили, однако, что эти 1 [2] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 |