
 | |
|
Слаботочка Книги 1 [2] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 рость кристаллизации; с- концентрация паяемого металла в расплаве припоя. к моменту насыщения расплава припоя паяемым металлом между ними устанавливается динамическое равновесие, т. е. шр - = О, где - концентрация насыщения расплава припоя паяемым металлом. Подставив Б уравнение (1) cV- = N и приняв во вн иман ие п редыду щее равенстго, получим - wp I - где -объем расплавленного припоя. Рассмотрим три случая. 1. Проинтегрировав выражение (3) по времени и приняв концентрацию основного металла в расплаве припоя в начальный момент растворения равной нулю, получим уравнение, описывающее процесс растворения: с~ с. I -е 2. Если растворение паяемого металла определяется диффузией В жидкой фазе, то \жО - коэффициент диффузии атомов паяемого металла в жидком припое; б - толщина пограничного слоя * Е ЖИДКОМ металле Скорость изменения концентрации паяемого металла в припое Интегрируя по времени с учетом равенства концентрации паяемого металла р расплаве припоя в начальный * При анализе гроцессов растврсе&ия реалкчйют (.тадню образования спокойного слоя жидкости иа границе с твердым металлом и стадиво диффузии из пограничного слоя в область ионвектинных потоков. момент растворения нулю, получаем кинетическое уравнение процесса растворения, определяемого диффузией в жидкой фазе: I -е 3. Когда скорость растворения зависит ОТ скорости перехода атомов паяемого металла в расплав припоя и от скорости диффузии в жидкой фазе, кинетическое уравнение примет вид где а - 1 -е шр D сомножитель показателя экспоненты, называемый константой скорости растворения (для первого случая а = - aip/c, для второго а £1/6). Как видно из уравнений (4), (7) и (8), во всех трех рассмотренньах случаях кинетика растворения характеризуется аналогичными зависимостями, а расплав насыщается по экспоненциальному закону. Из уравнения (8) следует, что кинетика растворения паяемого металла в расплавленном припое определяется соотношением физико-химических свойств взаимодействующих металлов, площадью контакта между ними и количеством жидкой фазы. Согласно экспериментальным данным процесс растворения лимитируется в большинстве случаев диффузией паяемого металла в жидкой фазе (первая стадия взаимодействия). Вторая стадия взаимодействия паяемого металла с расплавом припоя определяется их свойствами металлы, не растворимые в твердо.м состоянии, имеют ограниченную или непрерывную растворимость. В простейшем случае, когда паяемый материал и припой не растворимы в твердом состоянии, вторая стадия будет характеризоваться взаимной диффузией атомов паяемого материала и расплава припоя, а также выделением из расплава перенасыщающего жидкость паяе.мого металла При образовании ограниченных или непрерывных твердых растворов при кристаллизации на поверхность твердого металла выделяется сплав паяемого металла и припоя, соответствующий по составу (для двух-компонентной системы) точке пересечения изотермы температуры пайки с линией солидуса. Если исходное количество припоя в зазоре составляет Q, то после насыщения припоя паяемым металлом количество жидкого раствора составит Q/(l - Ф), где ф - коэффициент, определяющий содержание паяемого металла в жидкof растворе. Количество растворившегося паяемого металла в расплаве припоя будет [ -. Чтобы связать весь перешедший в расплав припоя паяемый металл в твердый раствор, потребуется следующее количество припоя: Ф (1 - Ч). (10) где ф - коэффициент, определяющий содержание паяемого металла в твердом растворе. В соответствии с выражением (10) количество припоя, избыточное по сравнению с необходимым для образования твердого раствора, которое диффундирует в паяемый металл, составит Qo = Q - Qi. Следовательно, время t (продолжительность кристаллизации во всем объеме зоны сплавления), в течение которого избыточное количество припоя продиффундирует в паяемый металл (рис. 4), эавнснт от количества расплава припоя, избыточного по отно-иению к необходимому для обр:30ва-ния твердого раствора: Qo = с.2{х, t) dx, (II) где - концентрация пщтся в диффузионной зоне; Л, н /12 -текущие координаты соотв?тственно границы ДНффузяокной зоны и межФазной границы паяемый металл-шов Третья Стадия взаимодействия при образовании раствсрно-диффузионного припои. Паяемый меш/зл (I) Рис, 4. Схема к расчету растворно-диффу= аиониого спая спая протекает по законам диффузии в твердой фазе. Контактно-реакционный спай. Контактное плавление - переход в жидкое состояние разнородных твердых материалов при температурах ниже точек их плавления. Это присуще как металлам, так и неметаллическим материалам. В основе контактного плавления лежат диффузионные процессы. Диффузия Б твердую фазу при наличии контакта взаимодействующих материалов может продолжаться до тех пор, пока концентрация второго компонента взаимодействующей пары в поверхностном слое не достигнет равновесного предела раствор [[.мости при данной температуре. После этого, если температура соответствует эвтектической или минимуму на линии солидуса, в системах начинается образование жидкой фазы. С момента ее возникновения дальнейшее взаимодействие контактирующих металлов происходит уже через слой расплава Образование твердого раствора в поверхностном слое металлов, находящихся в контакте с жидкой фазой, является процессом, непосредственно подгот;!Влн-вагощим плавление этого слоя. По-этолу и после возникновения жидкой Фазы контактное плавление рассматривается как процесс плзв-ения твердых растворов, образовавпгихся за счет дифф\-зии атомов зт-рго компонента из жидкости и ухода атомов первого компонента в жидкую фазу Принято считать, что с момента образования жидкой (Ьазы заканчивается первая стадия контактного плавления, связанная с взаимной диффузией компонентов в твердой фазе и образованием твердых растворов. Эта стадия в обшем случае описывается уравнением диффузии. Вторая стадия ко!)Тактного плавления определяется растворением твердых металлов в образовавшемся расплаве. При этом одновременно протекают два процесса - образование твердого раствора в поверхностных слоях взаимодействующих металлов за счет диффузии пз жидкой фазы и растворение образующегося твердого раствора в жидкой фазе. В зависимости от природы взаимодействующих металлов и температуры определяющими факторами второй стадии контактного плавления являются процессы, обусловленные ял и массо-переиосом а твердую фазу через жидкую прослойку (образование перенасыщенных твердых растворов и их последующее плавление), или растворением твердого металла в жидком. При затвердевании расплава, образовавшегося при контактном плавтении двух металлов, возникают два спая, различ-!.ых как по своей природе, так и по строению. Для определения направления развития процесса контактного плавления при постоянных температуре и давлении наиболее удобным критерием является изменение свободной энергии Гиббса. Зависи.мость Свободной энергии от состава для твердой и жидкой фаз в двойных системах автектического типа при температурах выше эвтектической приведена на рис, 5. При наличии контакта между 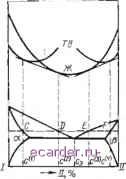 взаимодействующими металлами 1 и П в системе должны возникать процессы, уменьшающие ее свободную энергию. Такими процессами иогут быть диффузия в твердую фазу и контактное плавление образовавшихся в результате диффузии перенасыщенных твердых растворов. При диффузии уменьшение свободной энергии происходит вследствие образования твердых а- и р-растворов, при плавлении - в результате образования стабильной жидкой фазы. Поскольку процесс контактного плавления является необратимым, то для выяснения его направленности применены методы термодинамики необратимых процессов. Основным признако.м необратимых процессов является возрастание энтропии, являющейся однозначной функцией состояния системы. Общее уравнение энтропии находится из термодинамического уравнения Гиббса. Зная энтропии всех фаз, участвующих в контактном плавлении, можно рассчитать изменение энтропии системы, которое разделяется на внешнее d;s, обусловленное взаимодействием системы с внешней средой, п внутреннее d,s, обусловленное процессами, происходящими в самой системе. Основным критерием необратимости является положительное значение первой производной по времени от внутреннего изменения энтропии, или так называемого возникновения энтропии: При наличии жидкой фазы ивозник-новение энтропии для процессов взаимодействия твердого металла 1 с жидкостью ж, твердого металла И с жидкостью Жив системе i-Ж-П при постоянных давлении и температуре и при условии, что вся система замкнтая (объем ее в целом постоянен и здесь выполняются законы сохранения массы каждого ко.мпонента и энергии), определится из \ равнения dUTds-pdV - Рис. 5. Кривые сгооодной энергии (G) 1:>идкоы и твердой фas при температурах выше эвтектической в системе эвтектического типа Обозначив частную производную внутренней энергии по числу молен данного компонента (химический потенциал) через ПОЛУЧИМ dU=Tds-pdV-\- HiidMn k=i Tds = dU-\-pdV - \ivdMt fe--1 где s- энтропия; U - внутренняя энергия; p - давление; V-объем; - химический потенциал компонента К; Мк - число молей компонента К- Для случая взаимодействия фаз I и Ж возникновение энтропии запишется как \ dt Ji-ж Т \ dt dt dM.: Выражение для случая взаимодействия фаз П и Ж аналогично. Для всей замкнутой системы I-Ж-II суммарное в возникновение энтропии выразится только через слагаемые, заключающие в себе химические потенциалы, поскольку для всей системы в целом внутреннее изменение энергии равно нулю и объем всей системы дшжен оставаться постоянным dt У1 ж-[1 di Закон сохранения массы каждого компонента для всей системы 1-Ж-П: dMl + dM -Ь dMf = О и dMf~{dMldM). Тогда выражение для возникновения энтропии сястемы I-Ж-П примет вид: fdi\ \ dt /1 ж-II ( г) (ж ( 5г) \ dt ;1 ж-11 (12) Из этого выражения следует, что контактное плавление будет протекать до тех пор, пока не исчезнет хотя бы одна из твердых фаз, например И, и dMidt не станет равно нулю. После этого процесс может идти только в сторону установления таких составов фаз 1 и Ж, чтобы химические потенциалы компонентов в них оказались равными. Химический потенциал, или свободная энергия Гиббса, определяется из соотношения Ui = дОдс, где G - свободная энергия Гиббса для данной фазы; с/ - концентрация i-ro компонента в этой фазе. Тогда выражение (12) примет вид: (Алл \ di /1 ж-и dM]} it \ dcit дск I Если исходить из среднего значения коэффициентов диффузии в объеме Паяемвт метал/} flaflCfitiiu. lEl Phc. 6. Схема к расчету контактно-реакционного спая взаимодействующих металлов, не учитывать изменения объема металлов при переходе его из твердого состояния в жидкое и изменения объема образующегося сплава по сравнению с объемами металлов, вступивших во взаимодействие, то уравнения диффузии для металлов I и I запишутся в следующем виде (рис. 6); д дх
где X - координата; Di и D - коэффициенты диффузии; и - коя-центрации продиффундировавших компонентов в диффузионной зоне; / - время. Рассматривая процесс контактного плавления относительно единичной площади контакта взаимодействующих металлов, определим долю металлов I и ]1 в единице объема расплава. JhmhilL- (О - h2{t)-h,(i) h2it)-hi{ty где /1ц - значение координаты начального положения стыка контактир\ ю-щих металлов (до плавления), Н- и /12 - текущие положения границы первого металла и жидкой фазы и границы второго металла и жидкой фазы. Скорость перемещения границ металлов I и II при контактном плавлении зависит от количества продифф\ нднро-вавшегс металла. а также от доли металлов I и II в единице объема жидкой фазы, т. е. = /ii [t) = /1 /г - /ii {I}, hAt)-hJ, (13) = -1 (О = K{t)-K\, (14) где и Co - скорости перемещения границ твердой и жидкой фаз соответственно металлов I и II. Систем;! (13) и (14) является системой дифференциальных уравнений для определения hi (/) и h. (t), причем и С21 Б выражения (13) и (14) входят при условии, что x-h{t), т.е. Cja = (/i2 (i), t]; C21 = C21 [hi (0, il Образование паяного соединения путем контактного плавления обычно происходит в условиях, когда второй металл контактирующей пары вводится в виде тонкой прослойки. В этом случае рассмотренные закономерности формирования контактно-реакционного спая имеют место лишь до момента расплавления прослойки второго металла в результате контактного плавления. Диспергированный спай. По воздействию на твердые металлы внешние среды подразделяют на: неактивные, практически не влияющие на механические свойства металлов (сухой воздух, большинство углеводородов); поверхностно-активные (химически неактивггые или малоактивные среды, такие, как растворы повер хностно-активкых веществ в углеводородах и иногда в воде); диффузионно-воздеиствующие (газы, растворяемые или гюглощаемые твердыми металлами, жидкие металлы); химически активные, вызывающие явления коррозии Это деление условно, так как характер и интенсивность воздействия на твердый металл существенно меняются в зависимости от температуры, продолжительности контакта, состояния поверхности твердого тела, наличия примесей как в окружающей среде, Tai и в паяемом металле и т. д. Действие активных сред начинается с адсорбции на границе раздела. Взаимодействие активных сред с металлом и Проникновение их в его объем является уже вторичным процессом, При пайке воздействие среды расплава припоя на паяемые металлы является основным фактором, определяющим свойства паяного соединения. В зоне шва могут происходить изменения физико-механических свойств паяемого металла, связанные g эффектом пластифицирования, адсорбционным понижением прочности, диспергированием, образованием твердых растворов и соединений в результате диффузии, растворения и т д. Воздействие на паяемые металлы расплавов припоев зависит от состояния поверхности паяемого металла, наличия на ней загрязнений, окисных пленок, а также от состояния пред-поверхностных слоев (наличие остаточных напряжений, наклепа, различных дефектов - от субмикроскопических до микроскопических в значительной степени определяет свойства паяного соединения). Если на поверхности паяемого металла Егмеются пленки с неметаллической связью, то они затрудняют доступ расплава к твердому металлу и ухудшают условия взаимодействия между ними. После механической обработки резанием воздействие расплава усиливается. Если же пая й металл подвергался полированию или накатке, что приводит к уменьшению поверхностных дефекте , то воздействие расплава снижается. Эффект понижения прочности связан с уменьшением поверхностной энергии твердых металлов и проявляется в первую очередь в тех случаях, когда взаимодействующие металлы имеют диаграмму состояния эвтектического типа, а расплавленный металл не вступает в химическое взаимодействие с твердым, растворяясь в нем ввесьма небольшом количестве. Эффект вивжения прочности твердых металлов наблюдается и тогда, когда паяелтый металл и расплавленный припой не вёладают взаимной растворимостью ♦6]. Роль межзеренных границ в этом явлении остается определяющей, поскольку в условиях снижения межфазной энергии под действием расплава границы зерен являются наиболее оспабтенным местом. Это связано с тем, что границы зерен обладают аяшчительным избытком свободной гин ввиду нескомпенсированности межатомных сил. Поэтому на поверхностях с избыточной свободной энергией происходит более активная адсорбция расплава, что приводит к снижению прочности. При образовании спая процесс диспергирования паяемого металла под действием расплавленного припоя протекает в условиях, характеризуемых высокой температурой, ограниченным катичеством жидкой фазы, активным процессом миграции расплавленного припоя в паяемый металл. В этих условиях длительность процесса диспергирования наряду с физико-химическими свойствами паяемого металла и припоя лимитируется количеством жидкой фазы в щве; максимальная длительность определится временем заполнения зазора дисперсными частицами. Если принять, что диспергирование паяемого металла при формировании спаев заканчивается образованием отдельных изолированных зерен со средним диаметром d и рассматривается спаи между металлами I (расплав) и II (паяемый металл), то можно провести расчет кинетики диспергирования. Концентрация металла I в диффузионной зоне €-12 определится из уравнения (рис. 7) Процесс диспергирования считается законченным, когда весь зазор будет заполнен дисперсными частицами (шариками), образующими кубическую упаковку. Тогда объем шариков будет составлять д.б, а объем расплава ] - п: 6 всего объема, образовавшегося после заполнения зазора
Рис, 7, Схема к расчету диспергированного спая 1 [2] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 |